全球生物制药公司深入布局肿瘤放射性药物
作者:jsba 发布日期:2025-05-22
大型制药公司和投资者正在涌入精准辐射领域,因为下一代越来越有效的靶向α粒子疗法有望以对健康组织的损害最小的方式破坏癌细胞。
Advan Cell在2月份筹集了1.12亿美元,用于试验一种可能同类最佳的前列腺癌靶向α放射疗法。该公司正在进行转移性前列腺癌的放射性核素治疗ADVC0011/2期试验。在过去两年中,诺华、礼来、阿斯利康和百时美施贵宝等参与者达成了一系列金额达100亿美元的交易。这四家大型制药公司押注于一种新的、更有效的放射性同位素,而不是迄今为止美国食品和药物管理局(FDA)批准的药物中使用的放射性同位素。新的α发射同位素疗法有望在肿瘤学领域引起轰动,因为它们直接向癌细胞提供聚焦辐射。

放射性药物是通过接头连接到放射性有效载荷的小分子、肽或抗体。这些含有放射性的治疗将辐射直接传递到肿瘤细胞,破坏细胞的DNA并导致细胞死亡,同时避免损坏周围健康组织。最畅销的放射性核素治疗药物是诺华的Pluvicto(镥Lu-177 vipivotide tetraxetan),于2022年被美国FDA批准用于转移性前列腺癌。Pluvicto使用同位素镥177,这是一种β放射,可释放高能电子在DNA中引起单链缺口,靶向前列腺肿瘤细胞上发现的前列腺特异性膜抗原(PSMA)。另一种获批的放射疗法,诺华的Lutathera(镥Lu-177 dotatate),使用相同的β放射镥-177,但将其靶向生长抑素受体2型(SSTR2)以治疗神经内分泌肿瘤。新出现的放射性核素试剂携带一种不同类型的同位素:α发射体。它们拥有一些关键优势——它们在更近距离调度更多的DNA损伤——导致药物开发人员越来越多地转向铅212、砹211和锕225。发射α放射性核素会抛出氦核(一种α粒子),虽然氦核的能量转移能力更强,但只能穿透少数细胞层。这导致仅在目标癌细胞中发生无法修复的双链DNA断裂,同时限制对附近健康细胞的额外损伤。
更具前景的是,通过将α发射器与生物分子相结合,这种短程损伤可以专门集中在肿瘤细胞上。在神经内分泌肿瘤上测试此类分子的试验的结果表现良好。这些结果包括Radio Medix的候选药物Alpha Medix的结果,该药物已获得Sanofi的许可,将铅212导联引导至SSTR2。它缩小了约55%患者的晚期新内分泌肿瘤,许多患者没有疾病证据。制药公司现在的目标是将这一成功扩展到其他类型的癌症。未来,将能够攻击癌症。
研究人员希望的难以治疗的癌症之一是高级别神经胶质瘤,这是一种浸润性和免疫性无抑制性脑癌。公司正在使用低密度脂蛋白受体、碳酸酐酶XII或L型氨基酸转运蛋白等靶标,这些靶标通常在神经胶质瘤中过表达。试验处于早期阶段(表1),但结果可能会很快出现,因为针对某个靶点的同位素也可以在治疗前和治疗期间可视化肿瘤,这种方法称为治疗诊断学。使用弱放射性同位素的成像使临床医生能够观察患者的病变以进行靶标表达,选择它们进行试验并跟踪药物的摄取以管理治疗的剂量。
放射性核素疗法甚至可能在其他靶向抗癌药物达到上限的地方发挥作用。例如,抗体-药物偶联物(ADC)非常有效,但受到不可接受的毒性特征的限制。相比之下,精确辐射可能会检测ADC由于有效载荷有限而无法处理的低表达靶标。即使对于具有低表达靶标的癌症,α辐射也足以摧毁它们。在制造过程中,也可以通过添加更多放射性来增加放射性药物的活性。体内,它们的机制很简单——它们不需要被带入细胞来发挥作用。
然而,开发人员面临的挑战是最大限度地提高肿瘤上的放射性,并将其保持足够长的时间,以便放射性同位素能够完全释放其细胞杀伤损伤,同时确保对附近健康细胞的损伤最小。这项工作仍在进行中,到目前为止,没有人突破这些跨目标的挑战。在输送放射性有效载荷方面,肽是大多数制药公司的首选(表1)。肽是放射性核素的完美递送系统,并具备全身半衰期短和通过子细胞快速清除等优点。然而,肾脏往往会重吸收氨基酸,因此限制该器官中的同位素积累很重要。
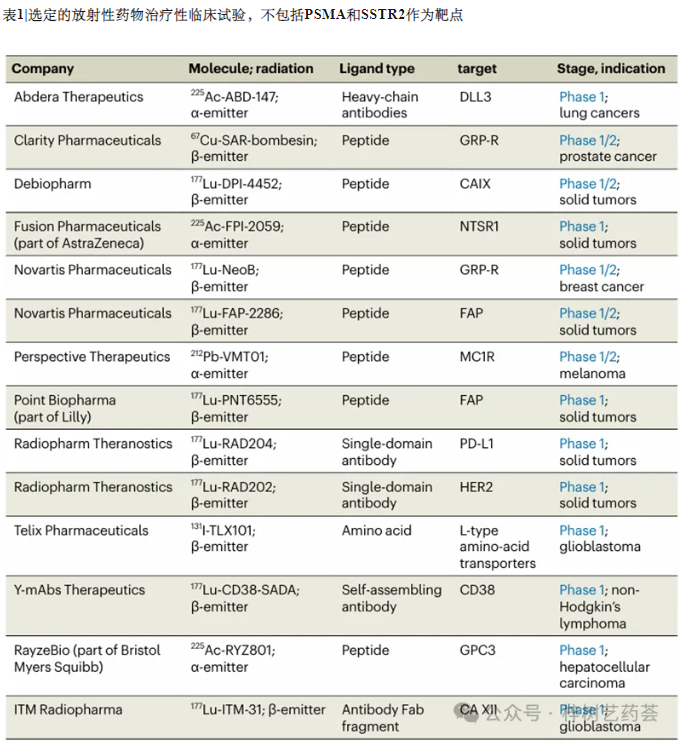
生物制药公司正在采用一系列新结构,以改进和增强肽的治疗性。Bicycle Therapeutics开发合成双环肽作为癌症靶点的配体;其先导分子处于2/3期试验中,由与毒素偶联的环肽组成。与现在进入放射性制药领域的其他几家生物技术公司一样,Bicycle最近利用其在ADC方面的经验进行了投资,现在正在采取行动加速其产品组合中的放射性药物候选药物。
将肽携带到靶标上并将其保留在肿瘤部位是由中国北京大学的研究人员设计的。他们开发了一种点击化学形式——将两个互补分子足够快、选择性地捕捉在一起以用于体内的反应——以α和β辐射靶向纤维原始细胞激活蛋白(FAP),这是一种在肿瘤基质中表达的泛癌靶点。当FAP配体与其靶标共价结合时,小鼠的摄取率比非共价配体高2.5倍,肿瘤保留率高13倍,并且具有更好的抗肿瘤作用。而且,在两名患者中,共价配体成像了更多的肿瘤病变。
抗体还可以递送具有极高特异性的放射性核素。缺点是抗体可以在体内停留数周,当与放射性结合时,可能会将辐射沉积在骨髓中并引起血液毒性。因此,制药公司现在越来越被具有抗体结合亲和力的肽模拟物所吸引,例如抗体片段、DARPins、环肽和微型蛋白。Bicycle Therapeutics的环肽可以满足这些要求。它们由两种线性肽组成,旨在模拟抗体的表位结合区域,通过化学支架折叠过滤并保持原位。Bicycle Therapeutics公司正在布局EphA2,一种受体酪氨酸激酶。其基于双环的黄斑放射线的短循环半衰期(40-60分钟)应该可以克服无法控制的出血副作用,这些副作用会阻止针对该靶点的ADC。预计2025年底将提供用于验证EphA2作为靶标的人体成像数据。
其他抗体模拟蛋白(设计的锚蛋白重复蛋白或DARPins)可以识别各种靶标,同时克服ADC的另一个缺点。例如,在某些肺癌和卵巢癌上表达的癌症靶点中皮素已被证明对ADC具有挑战性,因为它们倾向于结合脱落到循环中的可溶性间皮素。Molecular Partners设计DARPins,使用锚蛋白重复序列(介导蛋白质-蛋白质相互作用的天然锚定蛋白结构域)以高特异性和亲和力结合靶标。临床前研究中的一种此类DARPin将辐射引导到细胞表面间皮素——具体来说,是到一个小的膜近端区域。就灵敏度和特异性而言,这对于环肽等模式来说确实很难实现。该公司的放射线DARPin具有优化的骨架表面,以防止肾脏重吸收,并被设计为延长循环半衰期以促进肿瘤摄取。一种将放射性核素引导至细胞表面间皮素的DARPin候选药物正处于临床前研究中。另一种靶向DLL-3(Notch信号通路的抑制性配体)的lead-212候选药物预计将于2025年开始针对小细胞肺癌的首次人体研究。
其他几家公司已经设计了抗体功能单元,将小肽的优势(高溶解度和肿瘤渗透性)与传统单克隆抗体的卓越特异性相结合。Precirix是最早生成临床数据的生物技术公司之一。这家生物技术公司将β发射体碘-131连接到称为纳米体的工程单域抗体或片段上,以将放射性有效载荷输送到表达HER2的肿瘤。其单域抗体结合靶标并在肿瘤细胞上停留7天以上,未结合的放射性核素可在数小时内被肾脏迅速清除。该研究提供了机制的临床证据。“单域抗体作为一个定位概念,作为一个平台,是有效的。研究表明,该产品对HER2具有高度特异性,而不会引起血液毒性。该公司现在专注于放射性元素,以配合行业趋势,其最先进的项目针对FAP的α发射放射性核素。
其他开发人员认为全长抗体具有靶向放射性同位素的理想属性。Tagworks的战略是利用传统单克隆抗体的高亲和力、良好的肿瘤暴露率和低肾脏暴露量,一旦作用完成,它就会将抗体从放射性同位素上解开。该公司的点击释放技术使用可切割的连接子将同位素连接到靶向分子上。一旦药物注入患者体内并且抗体与靶标结合,就会注射四嗪分子,它使用点击化学来释放同位素。然后该同位素从体内迅速清除。tetrazine触发分子不具有细胞渗透性,因此它无法到达已被肿瘤细胞内化的抗体-同位素偶联物,从而确保放射性被困在肿瘤中。预计2025年晚些时候将开始一项首次人体试验,主要针对经过充分验证的HER2靶标的同位素。
包括Y-mAbs、Roche和OncoOne在内的其他公司以及学术团体正在探索相反的路线:只有在用抗体预靶向后才能连接放射性核苷酸。患者首先接受锁定在肿瘤上的未标记抗体或自组装抗体组分,任何未结合的抗体组分都会通过血液清除。然后向患者注射放射性示踪剂,该示踪剂通过点击化学或双特异性抗体相互作用与结合的抗体结合。任何多余的部分都会被快速清除。
一项成像试验正在胰腺癌细胞上使用CA19-9抗体测试这种称为预靶向的策略。更先进的是Y-mAb1期试验,使用自组装抗体片段将镥-177递送至非霍奇金淋巴瘤靶标CD38。在小鼠模型中未观察到骨髓毒性的证据。如果这种策略奏效,将只对肿瘤发挥作用而不损坏健康组织。该公司正在与Roche合作开发预定位方法。
一种策略布局超分子化学,专注于分子之间较弱和可逆的相互作用,例如氢键。科学家们可以应用这些非共价效应,使两个药物片段(其中一个封装放射性核苷酸)以可逆、非共价相互作用的方式保持在一起。可以向此类分子系统添加更多功能,例如多个放射性同位素或靶向片段,与传统的蛋白质或小分子工程相比,研究人员和制药公司可以更灵活地进行创新。
布局radio pharmaceuticals的另一个优势是它们可以用作低剂量辐射,以补充免疫疗法并提高其治疗癌症的有效性。一项试验发现,单次初免剂量的Pluvicto与PD1蛋白阻滞剂Keytruda(pembrolizumab)联合使用可缩小转移性前列腺癌患者的肿瘤。当与免疫肿瘤学药物联合使用时,调整放射性核素疗法以降低辐射剂量可能对儿童儿童癌症特别有效,因为尽量减少辐射剂量和暴露对年轻患者很重要。
皮茨堡大学的研究人员正在神经胶质瘤小鼠模型中测试这种策略,这种癌症约占儿童癌症的四分之一。研究表明,针对肿瘤相关髓系细胞上CD11b的α或β辐射典型剂量的1/50使肿瘤对免疫检查点抑制剂敏感。这导致存活率比单独使用检查点抑制治疗高得多。目前正在努力分析数据,并考虑可能进行临床试验。低剂量辐射作用的机制尚不确定,但辐射诱导的肿瘤细胞损伤可能会对肿瘤微环境产生免疫刺激作用,募集免疫细胞以增强抗肿瘤免疫力。对放射性药物领域的快速和大规模投资无疑将推动进一步的理解并促进进一步的创新。一些人警告不要急于选择配体或靶标,尽管如此,“Lutathera和Pluvicto可能只是先锋。现在,医生、风险投资家和生物技术公司的目光都集中在放射线药物领域。( 来源:抗体圈 )